Xcelerate 开发服务:
加速产品开发过程并降低风险
Aptar CSP Technologies 是一家真正的创新合作伙伴,为客户提供从构思概念到产品商业化的全套服务。我们的团队经验丰富,可以在开发过程中的任何阶段为您提供帮助,并运用他们的专业知识来确保您的项目获得最佳结果。
我们的技术先进,能够提供符合最严格客户规范的定制化解决方案,我们全面的方案能够帮助客户在市场上获得最有效的系统设计。
Xcelerate开发服务被Pharma Manufacturing杂志评为2019年全明星创新者,以“第一时间”提供合适的解决方案设计和活性包装研发,以加快产品上市。这套服务包括:
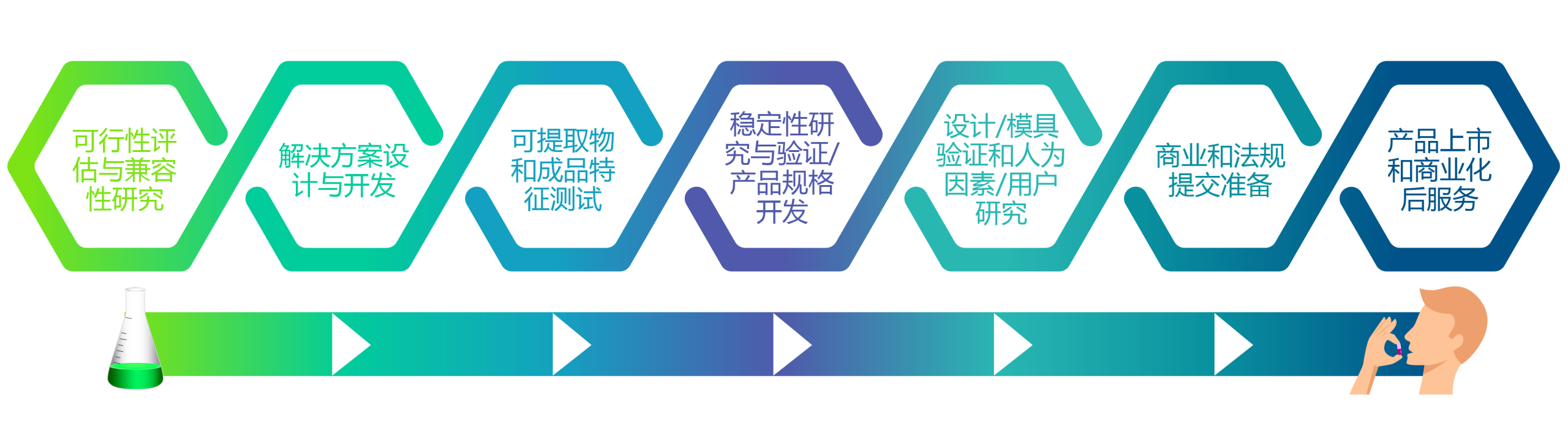
可行性评估和相容性研究
我们的可行性评估和相容性研究服务是确保快速、高质量开发满足您需求的理想解决方案的基础。Aptar CSP Technologies的工程师会与您的开发团队密切合作,在开发早期分析您的技术要求,确保我们提出的解决方案能够提供最佳保护。通过这种详细分析,我们能够创造满足稳定性和保质期要求所需的精确微环境,评估温度和其他环境因素如何影响性能,并了解产品中可能释放的气体对相容性的影响。
对于口服固体制剂项目,我们利用FreeThink Technologies的ASAPprime®软件来建模和测试经优化的活性包装解决方案,无需进行昂贵且耗时的生产线测试。这缩短了整个解决方案设计、测试和实现过程。药物表征、物理和功能性药物降解评估以及可行性样品是该服务的关键组成部分。
解决方案设计与开发
基于可行性评估和相容性研究结果,Aptar CSP Technologies开发了定制化的初步方案,以满足每种药物、药物递送系统、医疗器械或需要保护的诊断检测的特定需求。目前市场上已证实的解决方案包括口服固体制剂和益生菌的初级活性包装,Activ-Film™技术集成至包装材料、医疗器械、诊断试纸或经皮给药中,定制活性注塑组件替代给药装置中当前的聚合物部件。解决方案多种多样。
无论面临何种挑战,我们都会与客户一起开发定制的解决方案,采用精确的配方来满足他们的特定需求,从而得到最有效的组件和系统设计。该服务包括拟定解决方案的设计和效果图、稳定性测试原型设计、稳健性研究、法规合规性声明等。
可提取物和成品表征检测
评估各种化学物质从包装系统、药物递送装置或生产组件迁移至药物中的可能性是药物开发过程中的关键步骤。在药物批准之前,监管机构要求进行可提取物&浸出物检测,以识别产品完整性和安全性的任何风险。我们的可提取物和成品表征检测服务证实,将我们的技术整合到客户的解决方案中能够为其提供所需的最佳保护,而不会损害产品的有效性或安全性。我们将进行全面的检测,确保在活性聚合物解决方案中使用的化合物在最苛刻的条件下(如高温、延长接触时间或具有侵蚀性的溶剂系统)不会从接触表面迁移。
稳定性研究和验证/规范制定
选择设计后,Aptar CSP Technologies支持包装产品的样品制备,用于稳定性和临床研究, 包括GMP批次/产品、组装设计咨询、向执行灌装操作(CMO)的公司转让技术以进行稳定性评估(如需要),以及使用成品进行温度循环。我们对开发和生产过程的各个方面进行常规检测和分析,以确保所定制的材料科学解决方案满足或超越您对产品稳定性的关键要求。我们对科学创新和高质量过程的承诺确保我们的解决方案在真实条件下提供最高水平的稳定性性能。稳健性研究、强度测试、ISTA航运研究和跌落特性是该服务的重要组成部分。
设计/模具验证和人因工程/用户研究
人因工程和用户研究是确保任何器械或药物递送系统安全性的关键组成部分。Aptar CSP Technologies提供支持和咨询服务,包括产品使用培训和人为因素和用户研究的现场支持。我们将提供一份评估报告,可包含在药物或器械的FDA申报中。从设计/模具验证的角度来看,我们与客户合作创建规范,制定使用说明,并研究生产环境中的产能损失,以确保在商业化时不会出现意外。
商业化和监管提交准备
Aptar CSP Technologies在整个开发过程中提供全球监管合规性和支持,为我们在制药、医疗器械、诊断和食品安全行业的客户提供严格遵守监管指南的服务。在预提交过程中,我们与客户合作,浏览监管环境,助力加快向FDA提交的准备工作。关键服务包括DMF访问授权书、检查前准备和合规性声明。我们也可以作为您的咨询合作伙伴,与监管机构合作,促进与FDA 与NDA提交前的讨论。
除此支持外, Aptar CSP Technologies的生产厂商符合美国FDA规定的要求,并符合FDA现行药品生产质量管理规范(cGMP)法规。我们专有的3-Phase Activ-Polymer™配方包含在美国FDA药品DMF数据库(DMF#14789)中。Aptar CSP的工厂通过了ISO-9001、ISO-13485和ISO-14001认证。
上市和上市后商业化支持
Aptar CSP Technologies知道您的旅程不会止步于上市。因此,我们提供支持服务,帮助您完成上市并解决后续问题。Aptar CSP是您的预检准备合作伙伴,参与模拟审计或在实际审计期间提供现场支持。我们在FDA检查期间提供支持,并在现场审查期间提供文件和记录,助力您取得成功。需要时,Aptar CSP还可以与您合作进行风险评估和规避策略、调查管理、变更控制管理(内部维护)、记录控制、设计历史文件和管理以及关键质量属性的数据趋势分析。
